Vom Chaos zur Ordnung: Proteine strukturieren sich selbst, um wichtige Stoffe zu erstellen

Proteine steuern alle lebenswichtigen Prozesse in allen Organismen, zum Beispiel das Wachstum oder den Stoffwechsel. Eine Grundidee der Proteinforschung ist, dass die Struktur eines jeden Proteins bestimmt, wie es funktioniert. Ist die Struktur auch nur an einer Stelle gestört, kann das Protein seine Aufgabe nicht mehr ausführen - im menschlichen Körper etwa kann das zu schweren Krankheiten führen.
Es gibt allerdings zahlreiche Proteine, die ganz oder zumindest in Teilen über keine fixe Struktur verfügen. Diese sind nicht nur notorisch schwer zu untersuchen - sie verändern ihre Struktur auch je nach Umgebung. "Oft werden Proteine aus Proben isoliert und dann untersucht. So weiß man aber nicht, wie sie sich in ihrer natürlichen Umgebung verhalten. Wir haben ein Verfahren entwickelt, um Proteine unter möglichst realistischen Bedingungen zu untersuchen", sagt der Biochemiker Prof. Dr. Panagiotis Kastritis von der MLU.
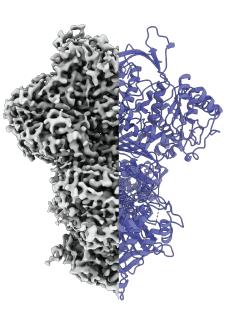
Sein Team untersuchte Proben des Pilzes Thermochaetoides thermophila, der in der Forschung als Modellorganismus genutzt wird. Im Zentrum der Arbeiten stand das Protein Myo-inositol-1-phosphate synthase (MIPS), das für die Produktion von Inositol wichtig ist. Der Stoff ist als Vitamin B8 bekannt und wird für viele wichtige Prozesse benötigt. Da er vom Körper selbst hergestellt werden kann, zählt er nicht zu den echten Vitaminen. "MIPS ist Teil einer längeren Stoffwechselkette, an deren Ende Inositol steht", erklärt Toni Träger von der MLU. Er untersuchte das Protein bereits während seiner Masterarbeit und forscht heute in der Gruppe von Kastritis. Mit Hilfe der Kryo-Elektronenmikroskopie beobachteten die Forschenden das Protein gewissermaßen bei der Arbeit. Sie fanden heraus, dass es in mindestens drei Zuständen existiert: in einem ungeordneten, einem geordneten sowie einer Art Zwischenzustand. "Bisher haben wir noch keine finale Erklärung, wozu es diesen dritten Zustand braucht. Vielleicht wird so Wasser aufgenommen, was die nachfolgenden Reaktionen begünstigt. Vielleicht passiert aber auch etwas ganz anderes", sagt Kastritis.
In einem weiteren Schritt untersuchten die Forschenden, ob ein ähnliches Verhalten in Proteinen zu finden ist, die mit "MIPS" verwandt sind. "MIPS" ist Teil einer speziellen Proteinklasse, den Isomerasen. Hierfür analysierte das Team Strukturdaten von mehr als 340 anderen Isomerasen. Und tatsächlich fanden die Forschenden deutliche Hinweise auf ein ähnliches Verhalten.
Die Erkenntnisse sind nicht nur für die Grundlagenforschung interessant. "Ein größeres Wissen über Stoffwechselwege und die beteiligten Proteine eröffnet womöglich neue therapeutische Ansätze. Unsere Arbeit liefert hierzu einen wichtigen ersten Schritt", sagt Kastritis abschließend.
Die Arbeit wurde gefördert von der Europäischen Union, dem Bundesministerium für Bildung und Forschung, der Deutschen Forschungsgemeinschaft im Rahmen des Graduiertenkollegs GRK 2467 "Intrinsisch ungeordnete Proteine - Molekulare Prinzipien, zelluläre Funktionen und Krankheiten" der MLU sowie aus Mitteln des Europäischen Fonds für Regionale Entwicklung.
Studie: Träger TK. et al. Disorder-to-order active site capping regulates the rate-limiting step of the inositol pathway. PNAS (2024). doi: 10.1073/pnas.2400912121